Sejarah Kimia Organologam
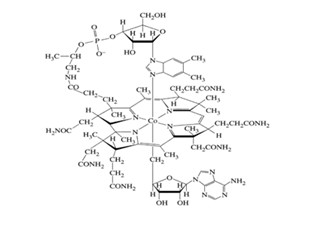
Kimia Organologam telah dimulai sekitar jutaan tahun yang lalu.Cobalamin atau vitamin B12
merupakan senyawa organologam yang telah ada di alam, karena sudah ada di alam
maka keberadaan senyawa organologam sudah ada sejak jutaan tahun yang lalu
bahkan sebelum manusia ada.Dilakukan Total synthesis pertama terhadap Senyawa
organologam pertama yaitu pada tahun 1972. Yang dimaksud Total sintesis yaitu
mensintesis suatu senyawa dari sangat awal bagaikan merangkai atom per atom.
Karena disintesis bagian perbagian maka senyawa cobalamin ini dibuat dalam
waktu yang sangat lama, sekitar 20 Tahun
senyawa organologam pertama yang ditemukan oleh cadet pada tahun
1760. Namun senyawa organometal yang ia hasilkan bukanlah hasil yang diharapkan
dari reaksi kalium asetat dan arsen trioksida . oleh karena itulah ada
yang tidak setuju dengan pendapat bahwa cadet yang pertama mensintesis senyawa
organometal.
Zeise menemukan senyawa organometal pertama yang memang
disengaja. Setelah itu, Birnbaum mengkorfimasi adanya ligand H2C=CH2 pada1868
yang mendukung penemuan Zeise. Sedangkan pada 1975, struktur sempurna dari
garam zeise terkarakterisasi sehingga membuktikan serangkaian penemuan dari
terdahulunya
Grignard Reagents (XMgR) disintesis sekitar 1900 oleh
victor Grignard Secara tak sengaja diproduksi ketika ingin membuat senyawa lain
Saytzeff method. Saat itu ia sedang melakukan penelitian dibawah bimbingan
dosennya bernama Barbier.
Keally, Pauson, dan Miller melaporkan synthesis ferrocene ini
secara tak sengaja, karena sebenarnya mereka ingin mensintesis fulvalen. Yaitu
senyawa sandwich hidrokarbon saja.
Ferrocene merupakan struktur yang sangat stabil
dengan struktur 2 benzene yang mengapit atom Fe, karena sangat stabil maka
penggunaan ferrocene ini sangat banyak. 1973 Nobel prize Geoffrey
Wilkinson dan Ernst Otto Fischer karena banyak penelitiannya pada senyawa
sandwich (metallocene).
1955 Ziegler dan Natta mengembangkan
polimerisasi olefin pada tekanan rendah menggunakan campuran katalis logam
(transition metal halide / AlR3)
Giulio Natta bekerja
pada penelitian bersama Ziegler menerapkan a-olefin yang lain seperti propylene
dan styrene pada reaksi polimerisasi. menghasilkan polypropylene dibuat
menjadi 2 fraksi: amorphous (atactic) dan crystalline (tactic).pada
1963 Nobel prize untuk Karl Ziegler dan Giulio Natta pada
katalis Ziegler-Natta yang nantinya digunakan secara komersil dalam pembuatan
plastik
Pada tahun 1962 Kompleks Vaska dilaporkan oleh Lauri Vaska ,
senyawa ini memiliki kemampuan adisi oksidasi dan dapat mengikat O2 secara
reversibel
Fulleren merupakan senyawa karbon yang saling berikatan
membentuk suatu bentuk bola yang berongga. Fulleren ini dapat menangkap senyawa
logam di dalamnya sehingga disebut juga metallofulleren.
Pengertian Senyawa Organologam
Senyawa kompleks organologam adalah senyawa kompleks yang
memiliki ikatan logam-karbon antara satu sampai delapan atom karbon dalam ligan
hidrokarbon terikat ke logam. Haptisitas mendeskripsikan jumlah atom dalam
ligan yang mempunyai interaksi koordinatif dengan logamnya dan jumlah ini
diberi simbol h (Huheey, 1993). Simbol h ini diikuti dengan superscriptyang
menunjukkan jumlah atom ligan yang ditambahkan pada logam. Misalnya, ligan
siklopentadienil dalam ikatan ferosen melalui kelima atomnya, sehingga menjadi
h5-C5H5. Rumus kimia dari ferosen ditulis
menjadi (h5-C5H5)2Fe (umumnya ligan
hidrokarbon ditulis sebelum logamnya). Pengucapan dari penulisan ligan h5-C5H5 adalah
ligan pentahaptosiklopentadienil (Miessler, 2003).
Senyawa kompleks organologam juga mempunyai suatu aturan dalam
menghitung jumlah elektron sama seperti aturan oktet (aturan 8 elektron) pada
kimia golongan utama. Aturannya adalah Aturan 18 Elektron. Aturan 18 elektron
adalah aturan yang menghitung jumlah elektron valensi pada logam pusat yang
berjumlah 18 elektron. Sama seperti halnya aturan oktet, aturan 18 elektron ini
juga mempunyai banyak pengecualian. Namun, aturan ini masih dapat dijadikan
pedoman untuk kompleks kimia organologam terutama ligan yang mengandung
akseptor-π yang
kuat (Miessler, 2003)
Sifat senyawa organologam yang umum ialah atom karbon yang lebih
elektronegatif daripada kebanyakan logamnya. Senyawa komplek logam (biasanya
logam-logam transisi) merupakan senyawa yang memiliki satu atau lebih ikatan
logam-karbon. Senyawa organologam terdiri dari atom pusat dan ligan (Blaser et
al, 2000).
Terdapat beberapa kecenderungan jenis-jenis ikatan yang
terbentuk pada senyawaan organologam:
a. Senyawaan ionik dari
logam elektropositif
Senyawaan organo dari logam yang relatif sangat elektropositif
umumnya bersifat ionik, tidak larut dalam pelarut organik, dan sangat reaktif
terhadap udara dan air. Senyawa ini terbentuk bila suatu radikal pada logam
terikat pada logam dengan keelektropositifan yang sangat tinggi, misalnya logam
alkali atau alkali tanah. Kestabilan dan kereaktifan senyawaan ionik ditentukan
dalam satu bagian oleh kestabilan ion karbon. Garam logam ion-ion karbon yang
kestabilannya diperkuat oleh delokalisasi elektron lebih stabil walaupun masih
relatif reaktif. Adapun contoh gugus organik dalam garam-garaman tersebut
seperti (C6H5)3C-Na+ dan
(C5H5)2Ca2+.
b. Senyawaan yang memiliki ikatan
-σ (sigma)
Senyawaan organologam dimana sisa organiknya terikat pada
suatu atom logam dengan suatu ikatan yang digolongkan sebagai ikatan kovalen
(walaupun masih ada karakter-karakter ionik dari senyawaan ini) yang dibentuk
oleh kebanyakan logam dengan keelektropositifan yang relatif lebih rendah dari
golongan pertama di atas.
Terdapat dua macam ikatan
organologam, yaitu :
1. Ikatan ionik. Ikatan ionik organologam
terbentuk dari unsur yang sangat elektropositif yaitu unsur pada golongan I,
II, dan III. Organologam dengan yang berikatan secara ionik bersifat tak larut
dalam pelarut hidrokarbon dan mudah teroksidasi.
2. Ikatan kovalen. Ikatan
kovalen organologam yang mudah menguap terbentuk dari logam Zn, Cd, Hg,
dan logam non-transisi gologan III (kecuali aluminium), IV, dan V. Ikatan
kovalen ini terbentuk dengan cara memberikan satu elektron tunggalnya, baik
dari logam maupun unsur organiknya, untuk dipakai secara bersama. Sifat dari
senyawa organologam dengan ikatan kovalen ini mudah menguap, larut dalam
pelarut organik, dan tidak larut dalam air.
Reaksi Grignard
Reaksi Grignard ditemukan oleh kimiawan Perancis Auguste Victor
Grignard (1871-1935) di tahun 1901. Tahap awal reaksi adalah reaksi pembentukan
metil magnesium iodida, reagen Grignard, dari reaksi antara alkil halida (metil
iodida dalam contoh di bawah ini) dan magnesium dalam dietil eter kering.
CH3I + Mg –> CH3MgI
Anda pasti melihat bahwa magnisium terikat langsung dengan
karbon. Senyawa semacam ini yang sering disebut sebagai reagen Grignard dengan
ikatan C-logam dimasukkan dalam golongan senyawa organologam. Ikatan C-logam
sangat labil dan mudah menghasilkan karbanion seperti CH3- setelah
putusnya ikatan logam-karbon. Ion karbanion cenderung menyerang atom karbon
bermuatan positif. Telah dikenal luas bahwa atom karbon gugus aldehida atau
gugus keton bermuatan positif karena berikatan dengan atom oksigen yang
elektronegatif. Atom karbon ini akan diserang oleh karbanion menghasilkan
adduct yang akan menghasilkan alkohol sekunder dari aldehida atau alkohol
tersier dari keton setelah hidrolisis.
C6H5CHO + CH3MgI –> C6H5CH(CH3)OMgI
Reaksi Grignard adalah contoh
reaksi senyawa organologam. Karena berbagai jenis aldehida dan keton mudah
didapat, berbagai senyawa organik dapat disintesis dengan bantuan reaksi
Grignard.
Jenis-Jenis Senyawa Organologam
1. Alkil dan Aril Litium
(Organolitium)
Senyawa Organolitium adalah senyawa Logam Alkali yang mempunyai
sifat kelarutan dalam Hidrokarbon atau cairan nonpolar dan penguapan yang
tinggi serta mempunyai sifat khas zat Kovalen. Penggabungan Molekular adalah
suatu keistimewaan yang penting dari alkil baik dalam kristal maupun larutan.
Jadi dalam Metil lithium atom-atom Li terletak pada sudut-sudut sebuah
tetrahedron dengan gugus alkil berpusat pada bidang dihadapannya. Gugus CH3 secara
simetris terikat pada tiga atom Li, dan ikatan jembatan alkil ini adalah dari
jenis tuna elektron berpusat banyak.
Dalam larutan, sifat spesies terpolimerisasi bergantung pada
pelarut, sifat sterik dari radikal organik dan suhu. Dalam Hidrokarbon MeLi,
EtLi, n-PrLI, dan beberapa lainnya adalah heksamer, namun tert-butilitihium,
yang tersolfasi. Tidak terdapat agregat yang lebih kecil dari pada tetramet.
Meskipun demikian, bilamana digunakan pengkelatan amin ditersier, seperti
tetrametiletilendiamen (TMED), Me2NCH2CH2NMe2 diperoleh
kompleks alkillithium monomer yang stabil. Alkil dan aril juga membentuk
kompleks dengan alkil logam lain seperti kompleks dengan Mg dan Zn. Sebagai
contoh:
2LiC6H5 +
Mg(C6H5)2→ Li2[Mg(C6H5)4]
Terdapat keragaman yang luas dalam kreaktifan perbandingan alkil, Li yang
bergantung kepada perbedaan dalam agresasi dan interaksi pasangan ion. Suatu
contoh adalah Bensinlitium, yang berupa monomer dalam tetrahidrofuran dan
bereaksi dengan suatu supstrat tertentu lebih dari 104 kali
lebih cepat dari pada metillithium tetramet. Kompleks TMED monomer yang
disebutkan diatas juga lebih jauh dari reaktif dari pada agregat alkil yang
bersangkutan. Alkillithium dapat mempolilithiasi asitilen,asetonitril, dan
senyawa-senyawa lain, jadi CH3C≡≡ CH
memberikan Li4C3, yang dapat dianggap sebagai turunan C34.
Reaksi alkil lithium umumnya dianggap bersifat sebagai ion karbon. Alkil
alkena, khususnya Isoprena, yang memberikan sampai 90% 1,4-cis-polilisoprena,
sebagai reaksi lainnya dengan alkena telah dipelajari kompleks TMED sekali lagi
luar biasa aktif, tidak hanya berpolomerisasi etilena namun bahkan akan
memelitisasi benzena dan senyawa aromatik, juga bereaksi dengan hidrogen pada 1
atm menghasilkan LiH dan alkana.
2. Senyawa Organo-Natrium dan
Kalium
Semua senyawa ini benar-benar ionik dan tidak larut sampai batas apa pun dalam
hidrokarbon karena sangat reaktif, peka terhadap udara, dan terhidrolisis kuat
dalam air.
Yang terpenting adalah senyawa natrium dari hidrokarbon asam seperti
siklopentadiena, idena, asitilena, dan sejenisnya. Ini diperoleh dari interaksi
dengan logam natrium atau natrium yang dihamburkan dalam tetrahidrofuran atau
dimetilformamida.
2CH5H6 +
2Na → 2C5H5-Na+ +
H2
RC≡CH + Na → RC≡C-Na+ +
½ H2
3. Magnesium
Senyawa organik dari Ca,Sr, dan Ba sangat ionik dan relatif tidak berguna,
namun senyawa magnesium mungkin adalah yang dipakai paling luas sebagai senyawa
organik yang digunakan sangat luas dalam kimia organik dan dalam sintesis senyawa
alkil dan aril dari unsur-unsur lain. Senyawa ini adalah jenis RMgX (pereaksi
Grignard) dan MgR2. Yang pertama dibuat dengan interaksi
langsung logam dengan suatu halida organik RX dalam suatu pelarut yang cocok,
biasanya suatu eter seperti dietil eter atau tetrahidrofuran. Reaksinya
biasanya paling cepat dalam iodida, RI, dan iod dapat digunakan sebagai suatu
pengionisasi. Pereaksi RMgX digunakan in situ. Spesies MgR2 paling
baik dibuat dengan reaksi kering.
HgR2 +
Mg (berlebihan) →Hg + MgR2
Dialkil atau diaril kemudian diekstraksi dengan sutu pelarut organik. RMgX
sebagai zat terlarut, maupun R2Mg adalah reaktif, dan menjadi peka
terhadap oksidasi dengan udara dan terhadap hidrolisis dengan air.Sifat
pereaksi Grignard dalam larutan adalah rumit dan bergantung pada sifat
gugus-gugus alkil dan halida pada pelarut, konsentrasi dan suhu. Solvasi
terjadi, dan penggabungan lebih utama terjadi dengan halida dari pada karbon
berjembatan, kecuali bagi senyawa metil dimana jembatan oleh gugus CH3 terjadi.
Dalam larutan encer dan dalam
pelarut donor yang lebih kuat, spesies monomer biasanya menonjol, namun dalam
dietil eter pada konsentrasi yang lebih besar dari pada 0,1Mpenggabungan
mmenghasilkan polimer linier atau siklis. Bagi pereaksi Grignard kristal, kedua
struktur RMgX.nS dimana n adalah jumlah molekul
pelarut, S, begantung pada sifat R, dan R(S)Mg(µ-X)2Mg(S)R telah
ditemukan. Atom Mg biasaya terkoordinasi tetrahedral.
Senyawa seng dan kadmium mirip
dengan senyawa magnesium namun berbeda dalam kereaktifannya. Alkil seng yang
lebih rendah adalah cairan yang mudah menyalah dalam udara dan bereaksi kuat
dalam air.
Reaksi Organologam
1. Insertion Reaction
Reaksi penyisipan merupakan suatu reaksi yang menyisipkan suatu
molekul kedalam suatu senyawa organologam. Molekul yang menyisip kedalam
senyawa organologam ini dapat bertindak sebagai 1,1 insertion dan 1,2
insertion, kedua hal ini merupakan suatu acuan bagaimana molekul ini
menyisipkan dirinya diantara logam dan ligan senyawa organologam yaitu
apakah menggunakan satu atom untuk mengikat logam dan ligan (1,1 insertion)
atau molekul tersebut mempunyai dua atom yang satu mengikat logam sedangkan
atom lain mengikat ligan (1,2 insertion). Contoh reaksi insertion dapat
ditunjukan dari siklus reaksi dibawah ini (reaksi penyisipan di dalam kotak).
Pada reaksi diatas dapat dijelaskan
bahwa senyawa HNi(CO)2Cl direaksikan dengan senyawa
RCH=CH2 maka senyawa RCH=CH2 akan
menyisip diantara logam dengan atom H. Reaksi ini merupakan 1,2
insertion, dimana ada dua atom C pada senyawa ini, satu atom C
mengikat logam Ni dan atom C yang lain mengikat H, akibatnya ikatan rangkap pada
molekul RCH=CH2 berubah menjadi tunggal karena elektronnya
dipakai untuk mengikat logam dan atom H.
2. Carbonyl Insertion (Alkyl Migration)
Reaksi penyisipan karbonil pada dasarnya sama seperti penyisipan
biasanya (1,1 insertion dan 1,2 insertion), tetapi yang
membedakan disini adalah yang masuk diantara logam dan ligan adalah molekul
karbonil (CO). Mekanisme reaksi dari penyisipan karbonil diusulkan ada tiga,
yaitu penyisipan secara langsung, migrasi karbonil, dan migrasi alkil. Dari
ketiga usulan mekanisme reaksi ini, dilakukan pengujian melalui eksperimental.
Hasilnya mekanisme penyisipan karbonil yang diterima atau sesuai hasil
pengujian adalah migrasi alkil. Jadi alkil bermigrasi dan terikat pada
karbonil, tempat yang ditinggalkan alkil tadi ditempati karbonil dari luar.
Contoh dari penyisipan karbonil diberikan pada siklus reaksi dibawah ini (dalam
kotak):
Dari kedua gambar diatas, dapat dijelaskan bahwa reaksi
penyisipan karbonil seperti dijelaskan pada pengantar singkat reaksi penyisipan
karbonil diatas, mekanisme reaksinya adalah migrasi alkil. Pada gambar diatas
ditunjukkan bahwa CH2CH2R bermigrasi ke CO, tempat kosong
pada logam yang ditinggalkan alkil tersebut selanjutnya diisi oleh CO dari
luar.
3. Hydride Elimination
Reaksi eliminasi hidrida ini yang sering ditemui adalah reaksi β-elimination yang merupakan suatu reaksi transfer atom H pada
suatu ligan alkil (pada ligan posisi β terhadap
logam) ke logam. Reaksi ini dapat menyebabkan meningkatnya bilangan oksidasi
dan bilangan koordinasi dari logam. Proses transfer atom H pada alkil posisi β ini terjadi apabila posisi logam, carbon α, karbon β, dan hidrida koplanar. Contoh
reaksi ini adalah pada siklus Wacker. Pada siklus ini terdapat reaksi β-hibrid-eliminasi (dalam kotak).
Pada reaksi diatas dinamakan reaksi β-hidrid-eliminasi karena pada molekul A, atom H yang
terikat pada atom O (pada gugus OH posisi β terhadap
logam), ditransfer menuju ke logam Pd. Pada contoh reaksi ini ternyata
reaksi β-hidrid-eliminasi tidak hanya atom
H milik alkil posisi β, tetapi dapat juga dari atom H
dari gugus hidroksil (OH) pada posisi β. Atom H yang ditransfer
ke logam Pd menyebabkan bilangan koordinasi logam Pd bertambah dari dua menjadi
tiga. Hasil akhir dari reaksi ini adalah terbentuknya molekul B.
4. Abstraction Reaction
Reaksi abstraksi merupakan suatu reaksi eliminasi ligan yang
tidak akan merubah bilangan koordinasi logam. Reaksi ini berkaitan dengan
pembuangan substituent pada ligan dengan posisi karbon α dan β terhadap logam. Pembuangan
substituent pada ligan ini dapat terjadi karena pengaruh suatu reagen
eksternal. Contoh dari reaksi ini adalah:
Pada reaksi diatas (dalam kotak) disebut sebagai reaksi
abstraksi dikarenakan terjadi pembuangan substituent yaitu atom H pada ligan η4-5-exo-RC5H5 (tetrahapto)
yang disebabkan oleh reagen Ph3CPF6. Dari hasil
pembuangan atom H ini, maka ligan η4-5-exo-RC5H5 berubah
menjadi η5-RC5H4. Bilangan koordinasi logam pada
reaksi ini tidak berubah, tetapi bilangan oksidasi logam Fe berubah dari Fe(0)
menjadi Fe(II).
Kita
ketahui jenis senyawa organologam ada 3,coba anda jelaskan perbedaan yang
spesifik dari ketiga jenis senyawa organologam tersebut!
Tolong bantuannya teman-teman
Tolong bantuannya teman-teman

















Tidak ada komentar:
Posting Komentar